¿Para qué sirve el pH, quien lo inventó y por qué lo homenajea Google?
Aunque quizás pocos se acuerdan, la escala de pH que nos enseñaron en el colegio es un concepto fundamental de la química


Muy pocos quizás se acuerden de la escala del pH que aprendimos en el colegio en la clase de química.
Y quizás muchos menos han oído hablar de Soren Peder Lauriz (S.P.L.) Sorensen el danés que inventó ese concepto.
Este martes el Doodle de Google celebra al bioquímico danés que acuñó el término de pH, la medida de acidez o alcalinidad que se convirtió en un concepto fundamental de la química y que ahora se utiliza como una medición importante en muchas áreas de la vida.
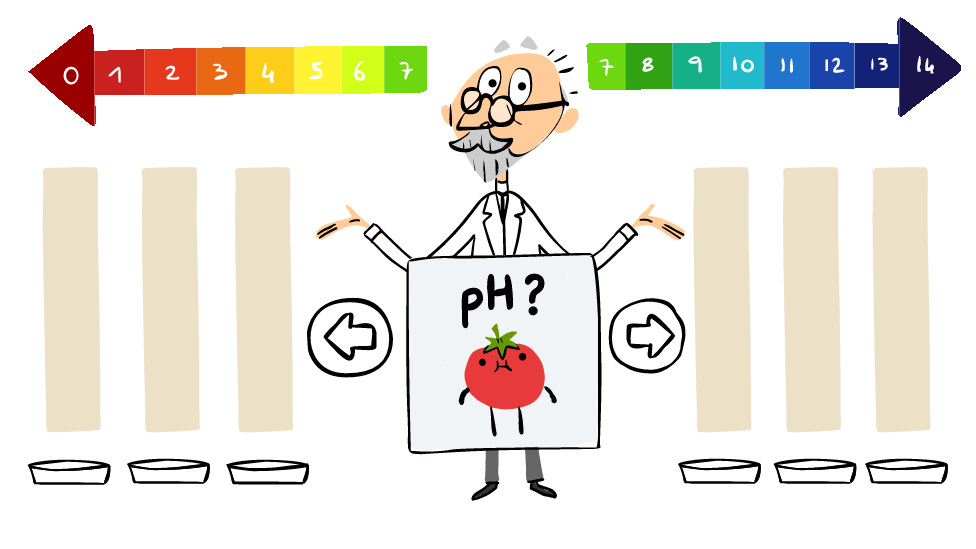
El Doodle de Google presenta una pequeña gráfica interactiva que muestra cómo es la escala de pH que diseñó Sorensen.
Quién fue S.P.L. Sorensen
Sorensen nació en Havrebjerg, Dinamarca, en 1868. Fue hijo de un agricultor y su deseo era hacer una carrera en medicina.

Comenzó sus estudios en la Universidad de Copenhague, pero bajo la influencia del químico S.M. Jorgensen decidió cambiar a química en la misma universidad.
Obtuvo su doctorado en 1899 con la asesoría de Jorgensen en síntesis inorgánicas y poco después de convirtió en director de la sección de químicos del Laboratorio Carlsberg, que había sido fundado en 1876 por el magnate de la cerveza J.C. Jacobsen.
Desde su fundación el laboratorio ha sido un importante centro de investigación y descubrimientos bioquímicos, en particular vinculados a la elaboración de cerveza.
Y cuando Sorensen trabajaba allí comenzó a estudiar aminoácidos, proteínas y enzimas.
Al investigar el efecto de la concentración de los iones sobre las proteínas creó en 1909 una forma simple de expresar la concentración de iones de hidrógeno en una solución: la escala de pH (potencial de hidrógeno).
Para qué sirve el pH
Sorensen diseñó la escala para medir la acidez o alcalinidad de una substancia: las soluciones que recibían valores de pH de 0 eran las más ácidas, las de 14 las más alcalinas.
Y el Doodle de Google te pide que adivines la acidez o alcalinidad de varios alimentos y bebidas, como tomates, limones, huevos, agua y brócoli. Los menores de 7 son ácidos, los mayores de 7 son alcalinos.
El 7 en la escala de pH es neutro y el agua y la sangre son ejemplos de sustancias neutras.
La fórmula continúa usándose hoy en día alrededor del mundo y es sumamente importante para una variedad de aplicaciones en nuestra vida diaria.
Estas incluyen los tratamientos de la tierra para cultivo: el pH de la humedad del suelo afecta la disponibilidad de nutrientes para las plantas.
Algunas plantas prefieren un suelo ligeramente ácido, otras un suelo menos ácido. Y cuando los suelos son sumamente ácidos alcanzan concentraciones de elementos químicos tóxicos para las plantas.
Los valores de pH también se utilizan para monitorear la acidez del agua. El agua de lagos, lagunas y ríos sanos generalmente tiene un pH de entre 6 y 8.

La mayoría de los peces tolera agua con pH de entre 6 y 9. Los animales más robustos por lo general mueren en pH más bajos o más altos.
Y el pH también se aplica en la alimentación: el pH del ácido gástrico es de entre 1,5 y 3,5, que es útil para descomponer los alimentos.
Algunos alimentos o combinaciones pueden provocar que el estómago genere más ácido y cuando esto ocurre la acidez podría llegar a perforar el estómago y causar una úlcera.
Demasiado ácido en el estómago puede escapar al esófago produciendo esa desagradable sensación llamada acidez.
Por otra parte, la sangre humana oscila en valores de pH de entre 7,35 y 7,45 (punto neutro de la escala).
Niveles mayores o menores pueden ayudar a diagnosticar problemas metabólicos o respiratorios.
Hoy en día la medición del pH en la sangre se ha convertido en un análisis sanguíneo de rutina para detectar enfermedades como diabetes o infecciones urinarias.
S.P.L Sorensen murió el 12 de febrero de 1939 a los 71 años, y a pesar de que a lo largo de su vida obtuvo varios reconocimientos, y de que su hallazgo es hoy un concepto fundamental de la química, nunca le otorgaron el Premio Nobel.